Combustível
Origem: Wikipédia, a enciclopédia livre.
Um combustível é qualquer substância que reage com o oxigênio (ou outro comburente) liberando energia, usualmente de modo vigoroso, na forma de calor, chamas e gases. Supõe a liberação da energia nele contida em forma de energia potencial a uma forma utilizável. Em geral se trata de algo susceptível de combustão mas há excepções que se explicam a seguir.
No meio que vivemos existem várias substâncias que estão ou podem ser usadas como combustível. Entre as sólidas incluem-se o carvão, a madeira e a turfa. O carvão é queimado em caldeiras para esquentar água, que pode vaporizar-se para mover máquinas a vapor, ou diretamente para produzir calor utilizável em usos térmicos (calefação). A turfa e a madeira são utilizadas principalmente para a calefação doméstica e industrial. A turfa foi utilizada para a geração de energia nas locomotivas, que utilizavam madeira como combustível, muito comum no passado.
Entre os líquidos usados como combustível encontramos os de origem vegetal ou animal, como o álcool e o óleos vegetais de rícino e gorduras a partir do século XX surgem os combustíveis minerais, considerados fósseis, são os derivados do petróleo como óleo diesel, o querosene e a gasolina (ou nafta).
Entre os combustíveis gasosos estão o gás natural ou os GLP (Gases Liquefeitos de Petróleo), representados pelo Propano e o Butano. As gasolinas e até os gases são utilizados para os motores de combustão interna.
Nos corpos dos animais em geral, o combustível principal é constituído por carboidratos, lipídios e, em certas circusntâncias, as proteínas, que proporcionam energia para os músculos, o crescimento e os processos de renovação e regeneração célular.
Por extensão se chamam também combustíveis às substâncias empregadas para produzir energia no reator nuclear no processo de fissão nuclear, embora este processo não seja de forma alguma uma combustão.
Tampouco é um combustível, na acepção estrita do termo, o hidrogênio quando utilizado no processo de fusão nuclear, que proporciona grandes quantidades de energia, no que se fundem quatro átomos de hidrogênio para converter-se em um de hélio. Este meio de obter energia não foi dominado adequadamente pelo homem (mas que em sua forma mais violenta, é a bomba de hidrogênio, conhecida como Bomba H). No Universo é comum, posto que é a fonte de energia das estrelas.
Os combustíveis fósseis são misturas de compostos orgânicos que se extraem do subsolo com o propósito de produzir energia por combustão. A origem desses compostos são seres vivos que morreram há milhões de anos. Consideram-se combustíveis fósseis o carvão, procedente de bosques do período carbonífero, o petróleo e o gás natural, procedente de outros organismos.
No meio que vivemos existem várias substâncias que estão ou podem ser usadas como combustível. Entre as sólidas incluem-se o carvão, a madeira e a turfa. O carvão é queimado em caldeiras para esquentar água, que pode vaporizar-se para mover máquinas a vapor, ou diretamente para produzir calor utilizável em usos térmicos (calefação). A turfa e a madeira são utilizadas principalmente para a calefação doméstica e industrial. A turfa foi utilizada para a geração de energia nas locomotivas, que utilizavam madeira como combustível, muito comum no passado.
História
O primeiro uso conhecido de combustível foi a combustão de madeira ou de varas pelo Homo erectus cerca de dois milhões de anos atrás.1 Durante a maior parte da história humana os derivados dos combustíveis foram as plantas ou gorduras animais, os únicos que eram usados pelos seres humanos. Carvão vegetal, um derivado de madeira, tem sido usada desde pelo menos 6 000 a.C. para os metais de fusão. Ele só foi suplantado pelo coque, derivado do carvão, como florestas europeias começaram a se esgotar em torno do século XVIII. Briquetes de carvão são comumente usados como combustível para cozinhar churrasco.2Entre os líquidos usados como combustível encontramos os de origem vegetal ou animal, como o álcool e o óleos vegetais de rícino e gorduras a partir do século XX surgem os combustíveis minerais, considerados fósseis, são os derivados do petróleo como óleo diesel, o querosene e a gasolina (ou nafta).
Entre os combustíveis gasosos estão o gás natural ou os GLP (Gases Liquefeitos de Petróleo), representados pelo Propano e o Butano. As gasolinas e até os gases são utilizados para os motores de combustão interna.
Nos corpos dos animais em geral, o combustível principal é constituído por carboidratos, lipídios e, em certas circusntâncias, as proteínas, que proporcionam energia para os músculos, o crescimento e os processos de renovação e regeneração célular.
Por extensão se chamam também combustíveis às substâncias empregadas para produzir energia no reator nuclear no processo de fissão nuclear, embora este processo não seja de forma alguma uma combustão.
Tampouco é um combustível, na acepção estrita do termo, o hidrogênio quando utilizado no processo de fusão nuclear, que proporciona grandes quantidades de energia, no que se fundem quatro átomos de hidrogênio para converter-se em um de hélio. Este meio de obter energia não foi dominado adequadamente pelo homem (mas que em sua forma mais violenta, é a bomba de hidrogênio, conhecida como Bomba H). No Universo é comum, posto que é a fonte de energia das estrelas.
Os combustíveis fósseis são misturas de compostos orgânicos que se extraem do subsolo com o propósito de produzir energia por combustão. A origem desses compostos são seres vivos que morreram há milhões de anos. Consideram-se combustíveis fósseis o carvão, procedente de bosques do período carbonífero, o petróleo e o gás natural, procedente de outros organismos.
Ver também
- Biodiesel
- Biocombustível
- Combustível sintético
- H bio
- Fontes alternativas de combustíveis
- Processo de Fischer-Tropsch
Referências
- Leakey, Richard. Origin of Humankind (em inglês). [S.l.]: Basic Books, 1994. ISBN 0-465-03135-8 Página visitada em 22 de maio de 2013.
- Hall, Loretta. Charcoal Briquette (em inglês). [S.l.]: How Products Are Made, 2007. Página visitada em 22 de maio de 2013.
Leitura adicional
- Ratcliff, Brian et al.. Chemistry 1 (em inglês). [S.l.]: Cambridge University press, 2000. ISBN 0-521-78778-5
Ligações externas
Comburente
Origem: Wikipédia, a enciclopédia livre.

Símbolo de risco "O" inerente as substâncias comburentes.
No caso de combustão espontânea
É o material gasoso que pode reagir com um combustível, produzindo a combustão.Por exemplo a chama viva e azul do fogão (Esta é azul, devido haver a combustão total do elemento combustível, com pouco resíduo de carbono) ou da queima de um material, que pode ser por exemplo a gasolina natural, altamente inflamável.
Tipos de comburentes
O mais comum dos comburentes é o oxigênio, pois intensifica a reação química. Porém há casos isolados de combustões em que o comburente é o cloro, onde o bromo produz chama verde, e se combinado com o cloro fica azulado; ou o enxofre que produz chama amarela. O flúor também é um comburente e seu manuseio é muito perigoso.Ver também
Categorias:
Triângulo do fogo
Origem: Wikipédia, a enciclopédia livre.
Há fogo quando há combustão. Combustão nada mais é do que uma reação química das mais elementares, geralmente uma oxigenação
O triângulo do fogo é a representação dos três elementos necessários para iniciar uma combustão. Esses elementos são o combustível que fornece energia para a queima, o comburente que é a substância que reage quimicamente com o combustível e o calor que é necessário para iniciar a reação entre combustível e comburente. Para que se processe esta reação, obrigatoriamente dois agentes químicos devem estar presentes: Combustível e Comburente.
Combustível: É tudo que é suscetível de entrar em combustão (madeira, papel, pano, estopa, tinta, alguns metais, etc.)
Comburente: É todo elemento que, associando-se quimicamente ao combustível, é capaz de fazê-lo entrar em combustão (o oxigénio é o principal comburente) .
Temperatura de Ignição: Além do combustível e do comburente, é necessária uma terceira condição para que a combustão possa se processar. Esta condição é a temperatura de ignição, que é a temperatura acima da qual um combustível pode queimar.
Além do triângulo de fogo, temos também o tetraedro de fogo que, além de incluir combustível, comburente e calor, também considera a reação em cadeia, pois para o fogo se manter aceso é necessário que a chama forneça calor suficiente para continuar a queima do combustível(1).
(1)http://www.bombeiros.com.br/br/bombeiros/glossario.php
Líquidos: gasolina, álcool, éter, óleo, etc.
Gasosos: metano, etano, etileno, etc.
Não Voláteis: São aqueles que, para desprenderem vapores capazes de se inflamar, necessitam aquecimento acima da temperatura ambiente (óleo combustível, óleo lubrificante, etc.)
Ponto de Combustão: É a temperatura do combustível acima da qual ele desprende vapores em quantidade suficiente para serem inflamados por uma fonte externa de calor e continuarem queimando, mesmo quando retirada esta fonte de calor.
Ponto de Ignição: É a temperatura necessária para inflamar os vapores que estejam se desprendendo de um combustível. Após ter visto tudo isto, podemos concluir que se abaixarmos a temperatura de um combustível, ou da região onde seus vapores flutuam, abaixo da sua temperatura de ignição, cessará a combustão. Este é o segundo método básico de extinção de incêndios, e é conhecido como resfriamento.
O agente universal utilizado no método do resfriamento é a água.
O triângulo do fogo é a representação dos três elementos necessários para iniciar uma combustão. Esses elementos são o combustível que fornece energia para a queima, o comburente que é a substância que reage quimicamente com o combustível e o calor que é necessário para iniciar a reação entre combustível e comburente. Para que se processe esta reação, obrigatoriamente dois agentes químicos devem estar presentes: Combustível e Comburente.
Combustível: É tudo que é suscetível de entrar em combustão (madeira, papel, pano, estopa, tinta, alguns metais, etc.)
Comburente: É todo elemento que, associando-se quimicamente ao combustível, é capaz de fazê-lo entrar em combustão (o oxigénio é o principal comburente) .
Temperatura de Ignição: Além do combustível e do comburente, é necessária uma terceira condição para que a combustão possa se processar. Esta condição é a temperatura de ignição, que é a temperatura acima da qual um combustível pode queimar.
Além do triângulo de fogo, temos também o tetraedro de fogo que, além de incluir combustível, comburente e calor, também considera a reação em cadeia, pois para o fogo se manter aceso é necessário que a chama forneça calor suficiente para continuar a queima do combustível(1).
(1)http://www.bombeiros.com.br/br/bombeiros/glossario.php
Índice
Classificação dos Combustíveis
Quanto ao Estado Físico
Sólidos: carvão, madeira, pólvora, etc.Líquidos: gasolina, álcool, éter, óleo, etc.
Gasosos: metano, etano, etileno, etc.
Quanto à Volatilidade
Voláteis: São aqueles que, à temperatura ambiente, são capazes de se inflamar (álcool, éter, benzina, etc.)Não Voláteis: São aqueles que, para desprenderem vapores capazes de se inflamar, necessitam aquecimento acima da temperatura ambiente (óleo combustível, óleo lubrificante, etc.)
Comburente
Na maioria das reações que geram a combustão, o comburente encontrado normalmente é o oxigênio. A porcentagem de oxigênio existente no ar atmosférico é de aproximadamente 21%. Sempre que a percentagem de oxigênio cair abaixo de 16%, o mesmo já não alimentará mais a combustão. Sempre que nós conseguirmos manter uma percentagem de oxigênio abaixo de 16% em determinado local, estaremos afastando um dos lados do triângulo do fogo, e consequentemente extinguindo o mesmo. A este método de extinção do fogo é dado o nome de ABAFAMENTO.Temperatura
Ponto de Fulgor: É a temperatura (uma para cada combustível), na qual um combustível desprende vapores suficientes para serem inflamados por uma fonte externa de calor, mas não em quantidade suficiente para manter a combustão.Ponto de Combustão: É a temperatura do combustível acima da qual ele desprende vapores em quantidade suficiente para serem inflamados por uma fonte externa de calor e continuarem queimando, mesmo quando retirada esta fonte de calor.
Ponto de Ignição: É a temperatura necessária para inflamar os vapores que estejam se desprendendo de um combustível. Após ter visto tudo isto, podemos concluir que se abaixarmos a temperatura de um combustível, ou da região onde seus vapores flutuam, abaixo da sua temperatura de ignição, cessará a combustão. Este é o segundo método básico de extinção de incêndios, e é conhecido como resfriamento.
O agente universal utilizado no método do resfriamento é a água.
Categoria:
- Incêndios
Condutor
Origem: Wikipédia, a enciclopédia livre.

Esta é uma página de desambiguação, a qual lista artigos associados a um mesmo título.
Condutor ou Condutores podem referir-se a:
- Condução elétrica;
- Condutor elétrico, qualquer meio ou dispositivo em que se propaga a corrente elétrica;
- Condução térmica;
- Condutor, na sociedade, ou no código de estrada, é alguém que conduz algo, por exemplo o condutor de um veículo.
Ver também
- Semicondutor, sólidos cristalinos de condutividade intermediária
- Supercondutor, material submetido a determinadas condições que aumentam a sua condutividade
- Tubo
Condutor elétrico
Origem: Wikipédia, a enciclopédia livre.Condutores, no contexto da física e da engenharia elétrica, são materiais nos quais as cargas elétricas se deslocam de maneira relativamente livre. Quando tais materiais são carregados em alguma região pequena, a carga distribui-se prontamente sobre toda a superfície do material.1
Nos sólidos que possuem elétrons livres, como os metais, é possível que a carga elétrica seja transportada através deles, por isso dizemos que são condutores de eletricidade.2 Nesses materias, o movimento de cargas elétricas é composto por cargas negativas.3 Materiais como o cobre, o alumínio e a prata são bons condutores.
Sais, quando dissolvidos ou fundidos, subdividem-se em partículas eletricamente carregadas que, agora livres, também permitem o movimento de cargas em seu interior.4
Isolantes não permitem o movimento de cargas elétricas em seu interior. Entretanto, se a tensão elétrica aplicada em suas extremidades for superior à sua rigidez dielétrica, tornar-se-á um condutor.5
Trabalhos realizados sobre uma nova classe de condutores, feitos a partir de polímeros, foi o motivo que concedeu o Nobel de Química de 2000 aos seus premiados.6 7
Índice
Propriedades
Em alguns materiais, como nos metais, o eletrão mais externo em cada átomo é livre de se movimentar pelo material; existe assim uma “nuvem” muito densa de eletrões (eletrões de condução), com densidade constante se o material for homogêneo. Esse tipo de material é designado de condutor. Se o condutor for colocado numa região onde existe campo elétrico, como a nuvem eletrônica tem carga negativa, desloca-se em sentido oposto às linhas de campo. Assim, acumulam-se eletrões num extremo, ficando com excesso de carga negativa, e no extremo oposto aparece uma carga do mesmo valor mas com sinal positivo (falta de eletrões). Essa acumulação de cargas no condutor cria um campo interno oposto ao campo externo; quando os dois campos se anularem, o movimento da nuvem eletrônica cessará.8
No lado esquerdo da figura mostra-se o que acontece quando aproximamos uma barra, com carga positiva, a uma esfera condutora isolada. A nuvem eletrônica aproxima-se da barra. Se a barra tivesse carga negativa, a nuvem eletrônica afastava-se dela. Nos dois casos, o resultado é a indução de carga de sinal oposto perto da barra, e carga do mesmo sinal na região mais afastada da barra. A carga total da esfera continua a ser nula. Se a esfera não estivesse sobre um suporte isolador, as cargas do mesmo sinal da barra abandonavam a esfera, passando através do suporte para a terra.8
Nos materiais isoladores, os eletrões estão ligados a cada átomo. Quando uma carga externa é colocada perto do material, os eletrões e protões de cada átomo deslocam-se na direção das linhas de campo mas em sentidos opostos, sem sair do átomo. Assim cada átomo deforma-se criando um pequeno dípolo elétrico; nomeadamente, um sistema com carga total nula, mas com as cargas positivas e negativas separadas por uma pequena distância.
O lado direito da figura mostra a deformação de alguns dos átomos de uma esfera isoladora, quando é aproximada uma barra com carga positiva. Independentemente do sinal da carga da barra, em cada átomo as cargas de sinal oposto às carga da barra estarão mais perto da barra e a as cargas do mesmo sinal estarão mais afastadas; portanto, a força resultante da carga externa sobre cada átomo neutro será sempre atrativa, independentemente do sinal da carga externa. Assim, um material isolador é sempre atraído por um objeto externo com carga, independentemente do sinal dessa carga.8
Resistência
Quando uma tensão elétrica é aplicada entre duas extremidades de um condutor, uma corrente elétrica é estabelecida, fluindo de uma extremidade até outra. A oposição que o condutor faz à passagem dessa corrente, numa determinada tensão, pode ser caracterizada pela relação: Ver artigo principal: Resistência elétrica
Ver artigo principal: Resistência elétrica

Onde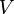 é o valor da tensão aplicada, medida em Volts e
é o valor da tensão aplicada, medida em Volts e  é o valor da corrente fluindo pelo condutor, medida em Ampères.
é o valor da corrente fluindo pelo condutor, medida em Ampères. 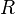 é a resistência elétrica, medida em Ohms.9 10
é a resistência elétrica, medida em Ohms.9 10
Ôhmicos e não-ôhmicos
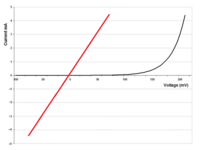
Condutores que apresentam sempre uma determinada corrente elétrica fluindo, em determinada tensão, consequentemente tem sempre a mesma resistência. Tais condutores são denominados ôhmicos, por obedecerem a lei de Ohm. Quaisquer outros condutores que não se comportem consistentemente com tal lei são denominados não-ôhmicos.10 11
Resistividade
A propriedade elétrica que determina se um material apresenta grande ou baixa resistência à passagem da corrente elétrica é a denominada: resistividade elétrica, típica de cada material e representada pela letra grega ρ. Esta é mensurada através da resistência(R), área de secção transversal(A) e distância entre os pontos de condução(l). A sua fórmula é: Ver artigo principal: Resistividade elétrica
Ver artigo principal: Resistividade elétrica
ρ = R*A/l
E sua unidade de medida é o ohm-metro (Ω-m).
Condutividade
Mas para se determinar se um material é bom ou mau condutor usa-se outra grandeza elétrica: a condutividade, representada pela letra grega, σ (lê-se sigma). Que nada mais é que o inverso da resistividade elétrica, ou seja: Ver artigo principal: Condutividade elétrica
Ver artigo principal: Condutividade elétrica
σ = 1/ρ
Sua unidade de medida é o [(Ω-m)^-1].
Condutores: apresentam condutividade alta, em torno de 10^7 [(Ω-m)^-1].
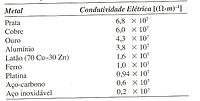
A figura ao lado mostra uma tabela com os valores de condutividade elétrica para alguns metais e ligas:
Estrutura de banda de energia (sólidos)
A condutividade elétrica está ligada fortemente ao número de elétrons disponíveis para a condução e estes buscam preencher os estados de energia mais baixos (estabilidade) a não ser que sejam submetidos à ação de forças externas (campo elétrico, por exemplo). A banda de energia eletrônica (ou banda de valência) é formada por estados atômicos que se dividem em subestados, ou estados eletrônicos. Quanto mais externas as camadas eletrônicas mais estas contribuem para a formação da banda eletrônica que é formada pelos elétrons da camada de valência do átomo. A banda vazia (ou banda de condução), como seu nome diz, é onde ocorre a condução elétrica propriamente dita, o movimento ordenado de elétrons por meio de uma diferença de potencial (d.d.p.). Quanto mais distantes as bandas, menor a condutividade elétrica.12 Existem apenas quatro tipos de estruturas de bandas a 0K (zero absoluto), e estão mostradas na figura à direita:
a) Típica de metais que apresentam um elétron na camada s; b) Encontrada em outros metais, há superposição de bandas (vazia com preenchida); c) Típica de isolantes, apresenta grande espaçamento entre bandas (gap); d) Característica dos semicondutores, tem distância pequena (< 2 eV) entre as bandas.
Características
Nos metais há imperfeições na estrutura cristalina que os levam a alterar sua resistividade, e por consequência sua condutividade. Segue abaixo a representação equacional dos responsáveis pela resistividade dos metais:
ρtotal = ρt + ρi + ρd (regra de Matthiessen)
em que ρt, ρi e ρd, são, respectivamente, as contribuições das resistividades térmicas (vibrações), devido às impurezas, e da deformação (plástica).13
Para os condutores, o aumento da temperatura resulta diretamente num aumento de resistividade, por conta de haver mais choques entre elétrons o que dificulta seu movimento ordenado. Tal aumento é linear e definido pela fórmula:
ρt = ρo + αT
sendo ρo e α, constantes para cada material específico.
Ver também
Referências
- SERWAY, Raymond A.; JEWETT Jr., John W. Princípios de Física: Eletromagnetismo. 1 ed. São Paulo: Cengage Learning, 2008. p. 679. vol. 3. ISBN 85-221-0414-X
- LUZ, Antônio Máximo Ribeiro; ÁLVARES, Beatriz Alvarenga. Física: Contexto & Aplicações. 1 ed. São Paulo: Scipione, 2011. p. 18. vol. 3. ISBN 9788526284647
- LUZ, Antônio Máximo Ribeiro; ÁLVARES, Beatriz Alvarenga. Física: Contexto & Aplicações. 1 ed. São Paulo: Scipione, 2011. p. 236. vol. 3. ISBN 9788526284647
- FELTRE, Ricardo. Química: Química Geral. 6 ed. São Paulo: Moderna, 2004. p. 190. vol. 1.
- SERWAY, Raymond A.; JEWETT Jr., John W. Princípios de Física: Eletromagnetismo. 1 ed. São Paulo: Cengage Learning, 2008. p. 748-749. vol. 3. ISBN 85-221-0414-X
- VOLLHARDT, K. Peter C.;SCHORE, Neil E.. Química Orgânica: Estrutura e função. 4 ed. Porto Alegre: Bookman, 2004. p. 514-515. ISBN 85-363-0413-8
- The Nobel Prize in Chemistry 2000 (em Inglês). Página visitada em 02 de Setembro de 2012. "The Nobel Prize in Chemistry 2000 was awarded jointly to Alan J. Heeger, Alan G. MacDiarmid and Hideki Shirakawa "for the discovery and development of conductive polymers"."
- [ Eletricidade e Magnetismo. Porto: Jaime E. Villate, 20 de março de 2013. 221 págs]. Creative Commons Atribuição-Partilha (versão 3.0) ISBN 978-972-99396-2-4. Acesso em 09 jun. 2013.
- LUZ, Antônio Máximo Ribeiro; ÁLVARES, Beatriz Alvarenga. Física: Contexto & Aplicações. 1 ed. São Paulo: Scipione, 2011. p. 121. vol. 3. ISBN 9788526284647
- SERWAY, Raymond A.; JEWETT Jr., John W. Princípios de Física: Eletromagnetismo. 1 ed. São Paulo: Cengage Learning, 2008. p. 770,771. vol. 3. ISBN 85-221-0414-X
- LUZ, Antônio Máximo Ribeiro; ÁLVARES, Beatriz Alvarenga. Física: Contexto & Aplicações. 1 ed. São Paulo: Scipione, 2011. p. 129. vol. 3. ISBN 9788526284647
- - CALLISTER, W. D. Ciência e engenharia de materiais uma introdução. 7ª Ed. Rio de Janeiro: LTC, 2008. 705 p.
- – VAN VLACK, L. H. Princípios de ciência dos materiais. 1ª Ed. São Paulo: Edgar Blücher, 1970. 427 p.





Nenhum comentário:
Postar um comentário
Observação: somente um membro deste blog pode postar um comentário.